Tác dụng phụ hiếm gặp và vụ kiện hàng tỷ euro khiến tương lai của vắc xin COVID-19 do AstraZeneca hợp tác đại học Oxford phát triển ngày càng trở nên mờ mịt.
Ngày 15.3, nhà huyết học Sue Pavord - giảng viên đại học Oxford - phát hiện 1 trường hợp sau khi tiêm vắc xin của AstraZeneca thì bị đông máu nghiêm trọng, nhưng lượng tiểu cầu (tế bào hỗ trợ chức năng cầm máu bằng cách tạo ra cục máu đông) lại rất thấp. Bà đánh giá xảy ra hai hội chứng cùng lúc là chuyện bất thường.
Nhà huyết học Pavord từng dành thời gian ở Canada nghiên cứu hội chứng giảm tiểu cầu do Herapin (HIT) thường xảy ra 5 ngày sau khi sử dụng Herapin điều trị bệnh. Lần này bà cùng đồng nghiệp ghi nhận tình trạng tương tự ở hàng loạt người tiêm vắc xin của AstraZeneca.
Sau đó bà được con trai 25 tuổi thông báo anh vừa tiêm vắc xin của AstraZeneca. Nhà huyết học Pavord lập tức cảm thấy phải gấp rút làm rõ mọi chuyện.
Áp lực mà nhà huyết học Pavord đang mang suốt thời gian tìm hiểu tác dụng phụ đông máu cực kỳ lớn, lớn đến nỗi đôi lúc bà chỉ muốn hét lớn: “Hãy ngừng tiêm chủng lại!” mặc dù biết rằng vắc xin của AstraZeneca cứu sống nhiều người.
Từng có thời điểm loại vắc xin này được xem như “vũ khí lợi hại” giúp chống lại đại dịch: giá rẻ, hiệu quả, dễ vận chuyển do không cần bảo quản ở nhiệt độ cực thấp như vắc xin của Pfizer hay của Moderna.
Với AstraZeneca, đây là sản phẩm đem lại lợi thế cho công ty trong cuộc cạnh tranh chiếm lĩnh thị trường vắc xin COVID-19. Tuy hãng cam kết cung cấp trên cơ sở phi lợi nhuận cho đến khi dịch bệnh qua đi, triển vọng thương mại hóa sản phẩm rất sáng sủa.
Vắc xin của AstraZeneca cứu sống hàng nghìn người ở Anh, Ấn Độ và nhiều quốc gia khác. Nhưng tại châu Âu, hãng vướng vào vụ kiện với Liên minh châu Âu (EU) vì chậm giao vắc xin, tại Mỹ thì vẫn chưa được phê duyệt sử dụng.
Nghi ngại cũng bủa vây vắc xin của AstraZeneca do tác dụng phụ đông máu hiếm gặp, kém hiệu quả hơn các sản phẩm đối thủ trước biến thể vi rút phát hiện ở Ấn Độ và Nam Phi.
Triển vọng thương mại hóa
Một cựu nhân viên AstraZeneca tiết lộ hãng đặt mục tiêu “tham gia để chiến thắng”. Công ty sẽ giữ quyền sở hữu trí tuệ tại một số thị trường châu Âu có tiềm năng sinh lợi, đồng thời bắt tay các đơn vị như Viện Huyết thanh Ấn Độ cung cấp vắc xin cho quốc gia đang phát triển.
Theo nguồn tin, AstraZeneca đã thành lập một nhóm nhỏ xem xét khả năng thương mại hóa vắc xin COVID-19. Nhóm có thể tập hợp người có chuyên môn từ bộ phận khác nếu cần.
Giáo sư John Bell thuộc đại học Oxford - người giúp xây dựng nên quan hệ hợp tác phát triển vắc xin COVID-19 với AstraZeneca - hy vọng công ty sẽ tiếp tục đưa vắc xin ra thị trường . Ông tin tưởng triển vọng của sản phẩm ở quốc gia phát triển lẫn quốc gia đang phát triển đều rất sáng sủa, vì nhiều khả năng vắc xin này phải tiêm nhắc lại.
Cũng theo giáo sư Bell, vắc xin của AstraZeneca thông qua adeno vi rút đưa vật liệu di truyền SARS-CoV-2 vào cơ thể giúp tạo tế bào T – rất có ích cho điều trị ung thư bằng cách sử dụng tế bào T (nếu cần).
Nếu sau này nguồn cung dồi dào, AstraZeneca có thể tiến hành cạnh tranh về giá. Sản phẩm do hai đối thủ Pfizer, Moderna cung cấp hiện cũng đã có giá cao hơn, và họ còn dự định tăng giá.
Cách thức phân phối tiện lợi hơn cũng sẽ là một ưu thế cạnh tranh. AstraZeneca đang tài trợ cho dự án vắc xin dạng xịt vào mũi tại đại học Oxford.
Nếu AstraZeneca xác định thị trường vắc xin COVID-19 quá đông đúc nên muốn rút khỏi, AstraZeneca vẫn có thể thu lợi từ bí quyết khoa học liên quan đến chống nhiễm trùng, điều trị bằng kháng thể đạt được trong quá trình phát triển vắc xin.
Vụ kiện tại châu Âu và trắc trở tại Mỹ
Phiên xử vụ kiện EU - AstraZeneca tuần qua diễn ra khá căng thẳng, luật sư Hakim Boularbah đại diện cho AstraZeneca bác bỏ cáo buộc chậm giao hàng. Ông nhấn mạnh rằng tăng năng lực sản xuất hàng tỉ liều vắc xin là nhiệm vụ phức tạp.
EU khởi kiện vào cuối tháng 4. Theo hợp đồng, AstraZeneca cam kết nỗ lực cung cấp 180 triệu liều cho châu Âu trong quý 2.2021, tuy nhiên công ty sau đó cho biết chỉ giao được 70 triệu liều cho giai đoạn này.
Tòa dự kiến sẽ ra phán quyết trong vài tuần tới. EU tin rằng AstraZeneca nên chuyển hướng nguồn cung cho Anh, Mỹ hoặc nơi khác để hoàn thành hợp đồng với EU, nếu không họ phải bồi thường thiệt hại lên đến hàng tỷ euro.
The Financial Times nhận định động thái khởi kiện còn cho thấy EU không xem sản phẩm của AstraZeneca là “vắc xin cho tương lai”.
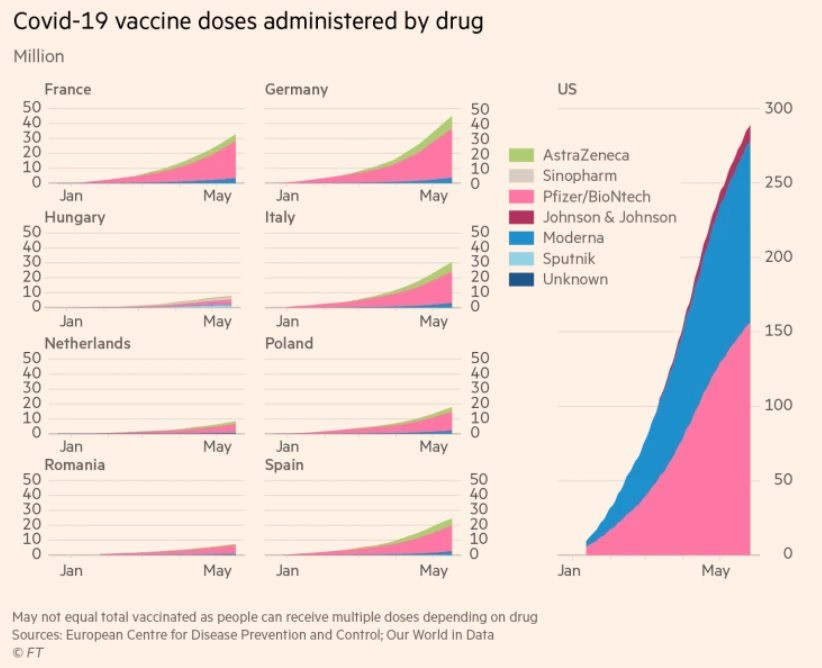
Đầu tháng 5, EU ký hợp đồng nhận 1,8 tỉ liều vắc xin của Pfizer từ cuối năm 2021 đến năm 2023. Vài quốc gia ngại sử dụng vắc xin của AstraZeneca: Đan Mạch phê duyệt sử dụng loại vắc xin này sớm hơn cả cơ quan quản lý dược phẩm châu Âu, nhưng nay đã hoàn toàn ngừng sử dụng; Pháp hiện dư thừa 2 triệu liều vắc xin AstraZeneca do chẳng ai muốn tiêm.
Bên kia Đại Tây Dương, Cơ quan quản lý Thực phẩm - Dược phẩm Mỹ (FDA) dường như chẳng hề vội vàng phê duyệt sử dụng vắc xin AstraZeneca. Chính phủ nước này thậm chí còn đặt thêm 100 triệu liều trữ cho mùa xuân từ Pfizer, Moderna, Johnson & Johnson. Washington không đặt hàng AstraZeneca nữa và chia sẻ một phần lượng hàng đang nắm giữ cho Canada, Mexico.
Giám đốc điều hành AstraZeneca Pascal Soriot khẳng định không có lý do gì để FDA không phê duyệt vắc xin của họ. Ông cho rằng nguyên nhân chậm trễ là vì phải tốn thời gian đối chiếu dữ liệu thử nghiệm, Mỹ hiện cũng không cần cấp bách triển khai chủng ngừa rộng rãi nữa.
Tại Anh, sản phẩm của AstraZeneca vẫn có vị thế quan trọng: nhận được đầu tư sớm để sản xuất và chiếm 60% tổng số vắc xin COVID-19 được phân phối. Nhưng đảo quốc sương mù còn rất nhiều lựa chọn khác để triển khai tiêm nhắc lại: Johnson & Johnson, Novanax cùng vắc xin do các hãng Valneva, Sanofi, GlaxoSmithKline phát triển vừa hoàn thành thử nghiệm lâm sàng giai đoạn 3.
Triển vọng ở quốc gia đang phát triển sáng sủa hơn. Chẳng hạn như tại Morroco – quốc gia đạt tỷ lệ tiêm chủng cao nhất châu Phi, vắc xin của AstraZeneca đóng vai trò lớn trong chiến dịch chủng ngừa rộng rãi. Họ đặt mua đến 25,5 triệu liều.
Phải tìm ra câu trả lời
Tại Anh, tỷ lệ bị tác dụng phụ đông máu hiếm gặp là 1/ 77.000 người tiêm. Nỗi lo ngại vẫn còn đó.
Nhà huyết học Pavord cùng giáo sư Andrew Pollard (điều tra viên chính về cuộc thử nghiệm vắc xin) đều nhất trí rằng máu của người tiêm thử nghiệm vắc xin AstraZeneca nên được xét nghiệm xem có tồn tại kháng thể đặc biệt lên quan đến đông máu hay không. Không cá nhân nào có kháng thể như vậy, do đó có thể đánh giá đông máu hiếm gặp là phản ứng phụ cụ thể trên một nhóm người nhất định.
Nhà khoa học người Đức Andreas Greinacher lý giải một số cá nhân có đặc điểm sinh học hiếm gặp nên phản ứng đặc biệt với vắc xin dùng adeno vi rút.
Dựa trên lý giải của nhà khoa học Greinacher, một nhóm nghiên cứu khác phát hiện vấn đề đông máu có liên quan đến protein đột biến trôi nổi trong dịch cơ thể 1 người cụ thể.

Ngay cả khi phát hiện trên là đúng thì sửa đổi vắc xin để ngăn ngừa xảy ra tác dụng phụ hiếm gặp cũng đầy thách thức. Giáo sư Bell cho biết đại học Oxford đang nghiên cứu khả năng sửa đổi vắc xin, nhưng ông thừa nhận rất khó chứng minh được bản sửa đổi đem lại thay đổi đáng kể – điều cần thực hiện thí nghiệm quy mô 5 - 10 triệu người mới đủ sức thuyết phục.
Có quan điểm nghĩ rằng tìm cách xác định người không tiêm được vắc xin của AstraZeneca để loại trừ sẽ dễ dàng hơn. Nhà huyết học Pavord cùng đồng nghiệp đang cố phân tích gen và so sánh chéo mẫu lấy từ ít nhất 34 trường hợp bị phản ứng nặng. Nếu phát hiện trùng lặp di truyền có ý nghĩa, họ có thể tìm ra nhóm nguy cơ cao.