Các nhà tiêm chủng trên khắp nước Mỹ đang báo cáo sự chậm trễ kéo dài hàng tuần với các lô vắc xin COVID-19 tăng cường được cập nhật của Moderna.
Sự chậm trễ diễn ra sau khi Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) đánh dấu mối lo ngại tại một cơ sở đã ký hợp đồng để đóng chai vắc xin Moderna.
Sự chờ đợi bắt nguồn từ một nhà máy ở bang Indiana (Mỹ) do tập đoàn đa quốc gia Catalent điều hành. Đó là một trong hai công ty đã đóng chai vắc xin Moderna ở Mỹ.
Sau một cuộc thanh tra, FDA trong tháng này đã quy lỗi cho nhà thầu Moderna vì thiếu sót trong các thủ tục kiểm soát chất lượng và không "điều tra kỹ lưỡng" các lô bị phát hiện nhiễm bẩn. Kể từ tháng 9.2020, Moderna đã nhận được 179 đơn khiếu nại về tạp chất trong lọ vắc xin COVID-19 của mình.
Việc kiểm tra của FDA đã ràng buộc quá trình cấp phép sử dụng khẩn cấp tất cả liều vắc xin COVID-19 mới được Catalent đóng chai và hoàn thành cho Moderna.
Song với lý do "những hạn chế về nguồn cung tiềm năng", Moderna đã gửi dữ liệu bổ sung cho cơ quan quản lý yêu cầu chuyển 10 lô vắc xin COVID-19 mới khỏi nhà máy Catalent.
FDA đã chấp thuận yêu cầu đó hôm 21.9. Moderna nói với cơ quan quản lý rằng họ có kế hoạch "gửi các yêu cầu tương tự cho các lô bổ sung trên cơ sở luân phiên" để giải phóng thêm hàng triệu liều vắc xin COVID-19 mới.
"Sự cấp phép dựa trên quyết định của FDA rằng các lô vắc xin đáp ứng tất cả thông số kỹ thuật hiện hành, sau khi xem xét cẩn thận thông tin do Moderna cung cấp về việc sản xuất các lô này. Cơ quan không lo ngại về tính an toàn, hiệu quả hoặc chất lượng của các lô này", Michael Felberbaum, người phát ngôn của FDA, cho biết trong một tuyên bố.
Tin tức về động thái của FDA được tờ The Washington Post đưa tin đầu tiên.
Christopher Ridley, người phát ngôn của Moderna, cho biết: "Chúng tôi dự đoán rằng những hạn chế về tính sẵn có của vắc xin sẽ được giải quyết trong những ngày tới. Chúng tôi tiếp tục đi đúng hướng để đạt được cam kết cung cấp 70 triệu liều vắc xin lưỡng trị cập nhật của chúng tôi vào cuối năm nay".
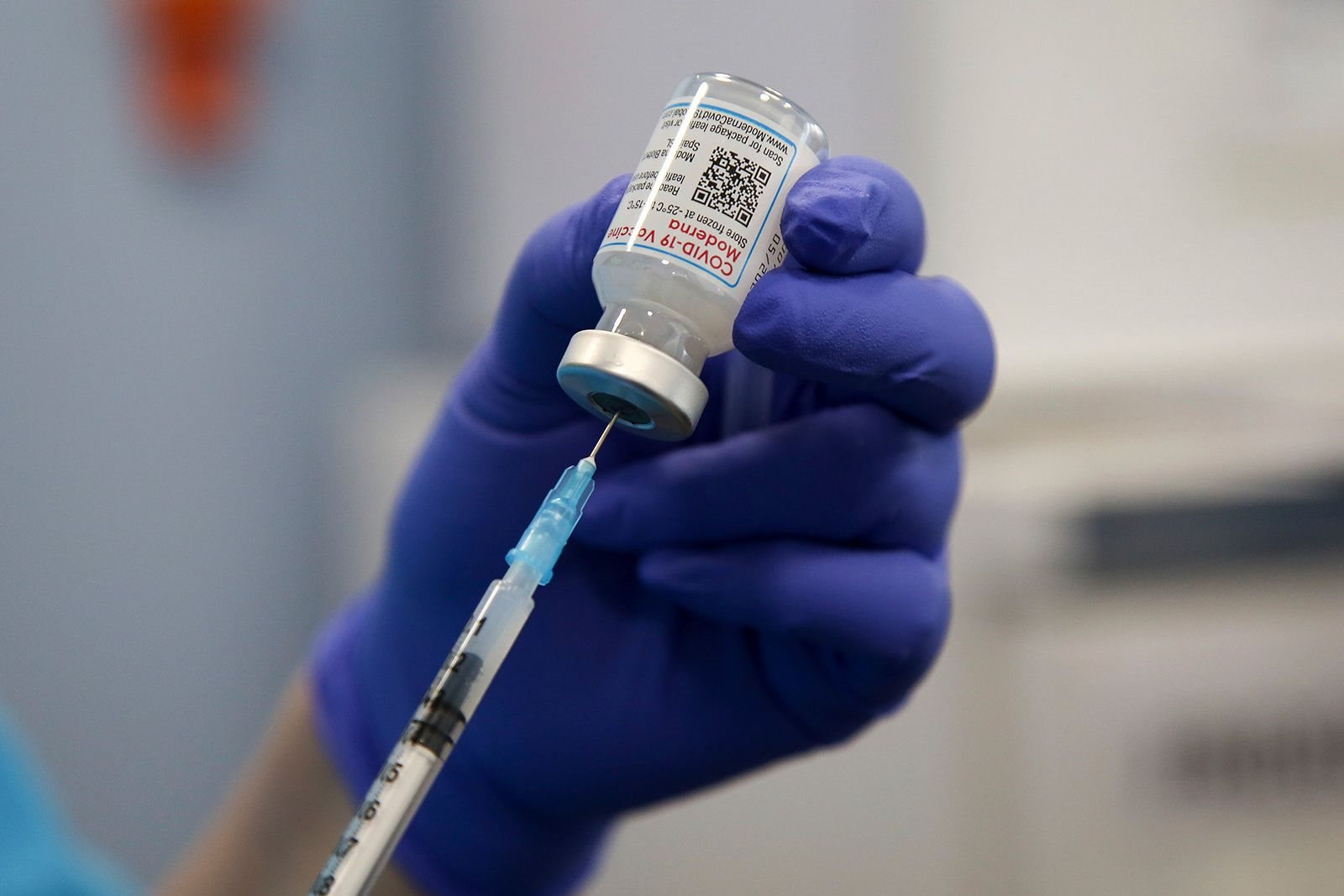
Sự trì hoãn đã dẫn đến việc triển khai chậm trễ vắc xin COVID-19 cập nhật kể từ khi chúng được chính thức cấp phép sử dụng vào ngày 1.9.
Một số bang đã đình chỉ đặt hàng vắc xin COVID-19 của Moderna, với lý do chậm trễ. Những người khác đã kêu gọi cư dân không chờ đợi vắc xin COVID-19 mới của Moderna.
Người phát ngôn Bộ Y tế và Dịch vụ Nhân sinh Mỹ cho biết 26 triệu liều vắc xin COVID-19 cập nhật đã được phân phối. Người Mỹ đủ điều kiện để tiêm một trong hai mũi vắc xin COVID-19 tăng cường của Pfizer hay Moderna, "bất kể đã nhận loại vắc xin chính nào trước đó".
Người phát ngôn Bộ Y tế và Dịch vụ Nhân sinh Mỹ nói: "Chúng tôi dự đoán rằng nguồn cung COVID-19 mới của Moderna sẽ tiếp tục tăng trong những ngày và tuần tới. Vắc xin COVID-19 cập nhật của Pfizer đã được phổ biến rộng rãi trên toàn quốc".
Người phát ngôn Pfizer nói công ty đã cung cấp "hơn 21 triệu liều vắc xin COVID-19 cập nhật", chiếm khoảng 80% nguồn cung của Mỹ cho đến nay. Pfizer có kế hoạch xuất xưởng lên đến 100 triệu liều vắc xin COVID-19 mới vào cuối tháng 11.
Julia Michelle Cohen, phát ngôn viên Pfizer, cho biết: “Riêng cơ sở ở thành phố Kalamazoo, bang Michigan của Pfizer đang sản xuất 10-15 triệu liều mỗi tuần với khả năng tăng đáng kể”.
Dữ liệu toàn quốc về số lượng liều vắc xin COVID-19 mới đã vận chuyển dự kiến sẽ được công bố vào ngày 22.9, quan chức của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Mỹ (CDC) cho biết tại một hội thảo trên web gần đây do Dự án Công bằng và Vắc xin COVID-19 tổ chức.
Các số liệu ban đầu từ CDC được công bố vào tuần trước cho thấy tỷ lệ tiêm vắc xin COVID-19 đã tăng lên mức cao nhất kể từ đầu tháng 5, khi mũi vắc xin tăng cường cập nhật bắt đầu trình làng.
Động thái của FDA diễn ra khi cơ quan quản lý cho biết đang làm việc để kiểm tra dữ liệu Moderna và Pfizer-BioNTech gửi đến việc cập nhật các mũi vắc xin COVID-19 tăng cường cho trẻ nhỏ.
Trong tài liệu lập kế hoạch được chia sẻ với các sở y tế tuần này, CDC cho biết hy vọng vắc xin COVID-19 lưỡng trị có thể sớm được sử dụng vào đầu đến giữa tháng 10 cho các nhóm tuổi trẻ hơn.
Các vắc xin COVID-19 của Moderna có thể là sự lựa chọn đơn giản hơn cho các bác sĩ gia đình và hiệu thuốc, do công ty có kế hoạch sử dụng các lọ vắc xin cho trẻ em dưới 6 tuổi giống người lớn.
"Một câu hỏi mà tôi sẽ trả lời ngay bây giờ là khi nào chúng ta sẽ có những loại vắc xin này cho trẻ nhỏ hơn? Và tôi nghĩ, với độ tuổi từ 5 tuổi trở lên, đó là vài vài tuần nữa", Tiến sĩ Peter Marks của FDA đã nói tại sự kiện ảo với Quỹ Quốc gia về Bệnh truyền nhiễm hôm 19.9.
Peter Marks cho biết thêm: “Với những đứa trẻ nhỏ tuổi nhất, có thể là cuối mùa thu này đến đầu mùa đông khi dữ liệu được đưa ra và chúng tôi có thể xem xét nó”.
Moderna đàm phán cung cấp vắc xin COVID-19 cho Trung Quốc
Moderna đã đàm phán với chính phủ Trung Quốc về việc cung cấp vắc xin COVID-19, nhưng vẫn chưa có quyết định nào được đưa ra, Giám đốc điều hành Stephane Bancel nói với Reuters hôm 14.9.
Khi phần còn lại của thế giới dần dỡ bỏ các hạn chế COVID-19, Trung Quốc tiếp tục tiến hành biện pháp phong tỏa và xét nghiệm hàng loạt để diệt trừ vi rút. Trung Quốc đã không phê duyệt bất kỳ vắc xin COVID-19 nước ngoài nào và dựa vào một số loại được phát triển trong nước.
"Chúng tôi cởi mở, chúng tôi có đủ năng lực", Stephane Bancel nói với Reuters bên lề một hội nghị truyền thông ở thủ đô Tokyo (Nhật Bản) về việc cung cấp các vắc xin dựa trên công nghệ mRNA cho Trung Quốc. Ông từ chối cho biết liệu Moderna đã gửi vắc xin COVID-19 của mình để được phê duyệt ở Trung Quốc hay chưa.
Người phát ngôn Moderna nói những cuộc thảo luận đó đã xảy ra trong quá khứ và không thể bình luận về việc liệu những cuộc đàm phán đó có còn tiếp tục không.
Stephane Bancel cho biết có khoảng 20% xác suất một biến thể SARS-CoV-2 "có vấn đề" có thể xuất hiện vào mùa đông này. Ông nói: “Chúng ta nên luôn khiêm tốn về sinh học”.
Phát biểu tại Tokyo, Stephane Bancel thông báo Moderna đang xem xét xây dựng các cơ sở ở Nhật Bản để sản xuất các sản phẩm có nguồn gốc từ mRNA.
Nhật Bản hôm 12.9 đã phê duyệt vắc xin COVID-19 tăng cường của Moderna và Pfizer nhắm vào biến thể Omicron.
Moderna đã kiện Pfizer và đối tác BioNTech vào tháng trước vì vi phạm bằng sáng chế trong việc phát triển vắc-xin COVID đầu tiên được phê duyệt tại Mỹ. Moderna tin rằng ngay từ đầu BioNTech đang sử dụng công nghệ và bằng sáng chế của mình, nhưng quyết định đợi cho đến khi đại dịch lắng xuống mới nộp đơn kiện, theo Stephane Bancel.